Firing Characteristics Analysis of the Fractional-order Extended Hindmarsh-Rose Neuronal Model under Transcranial Magneto-Acoustical Stimulation
-
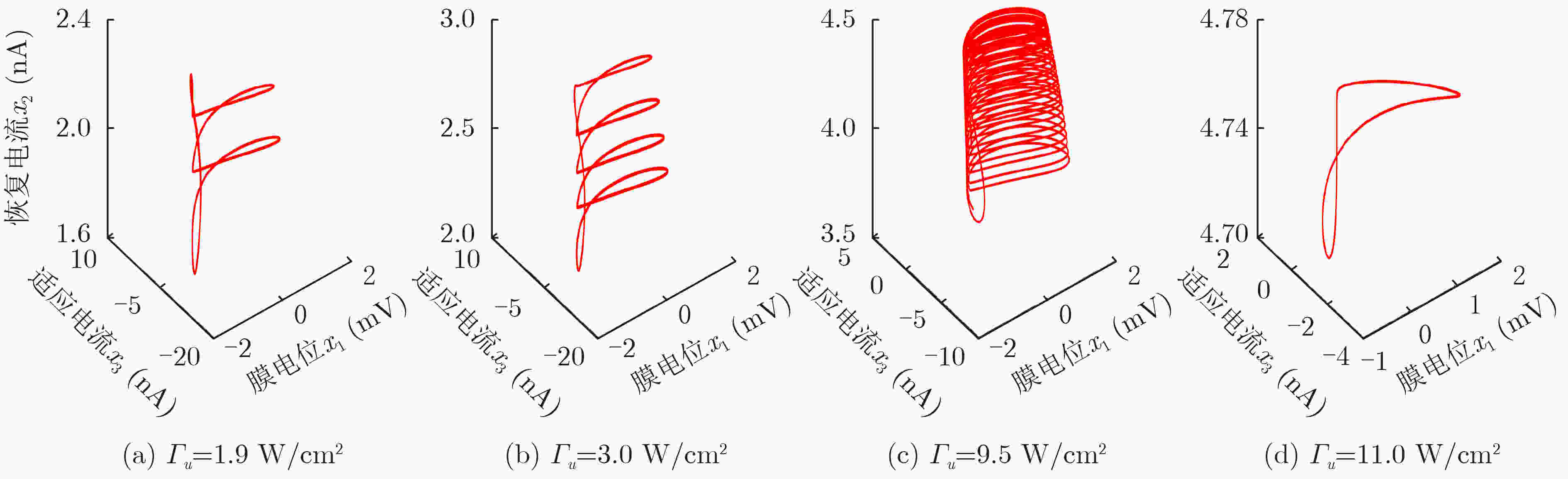
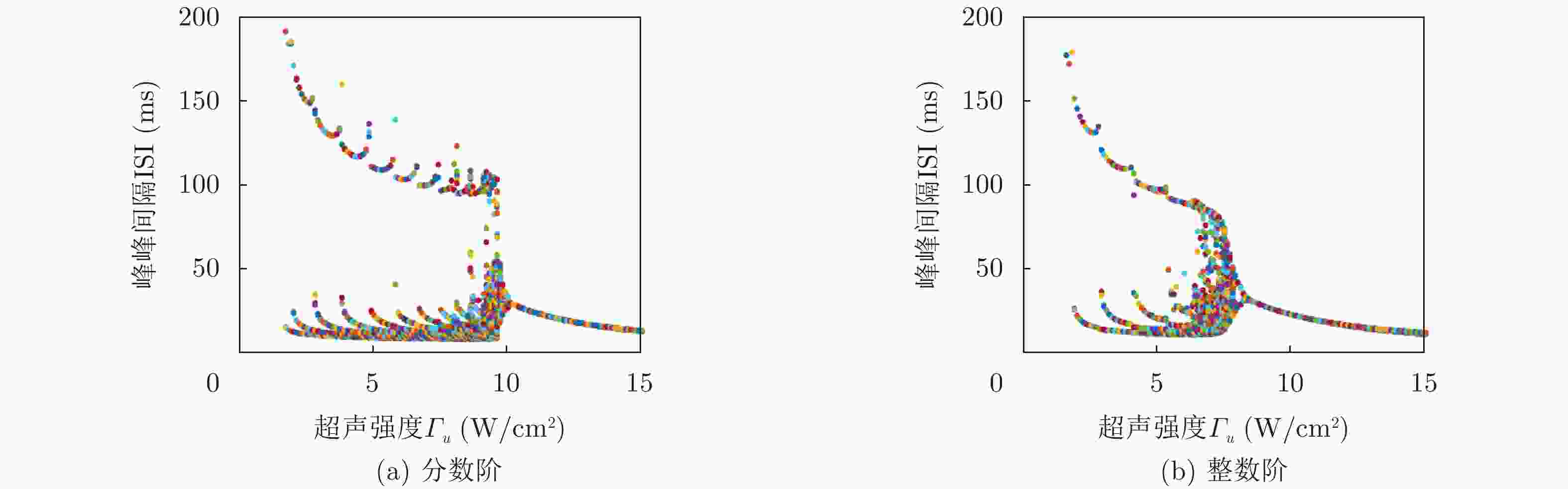
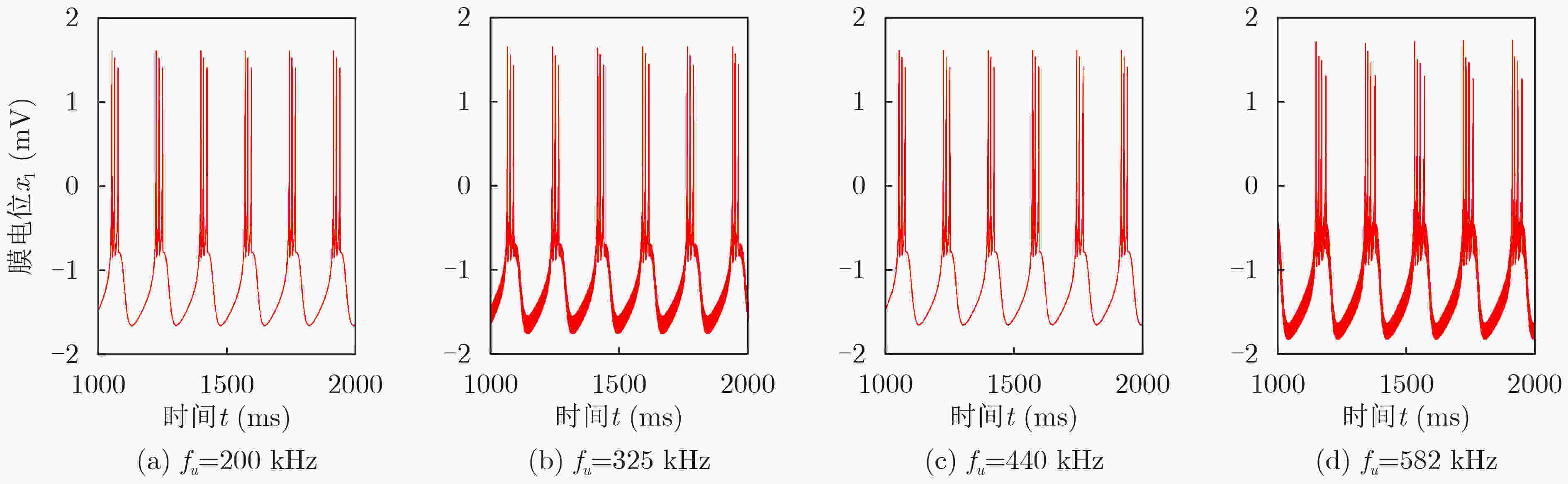
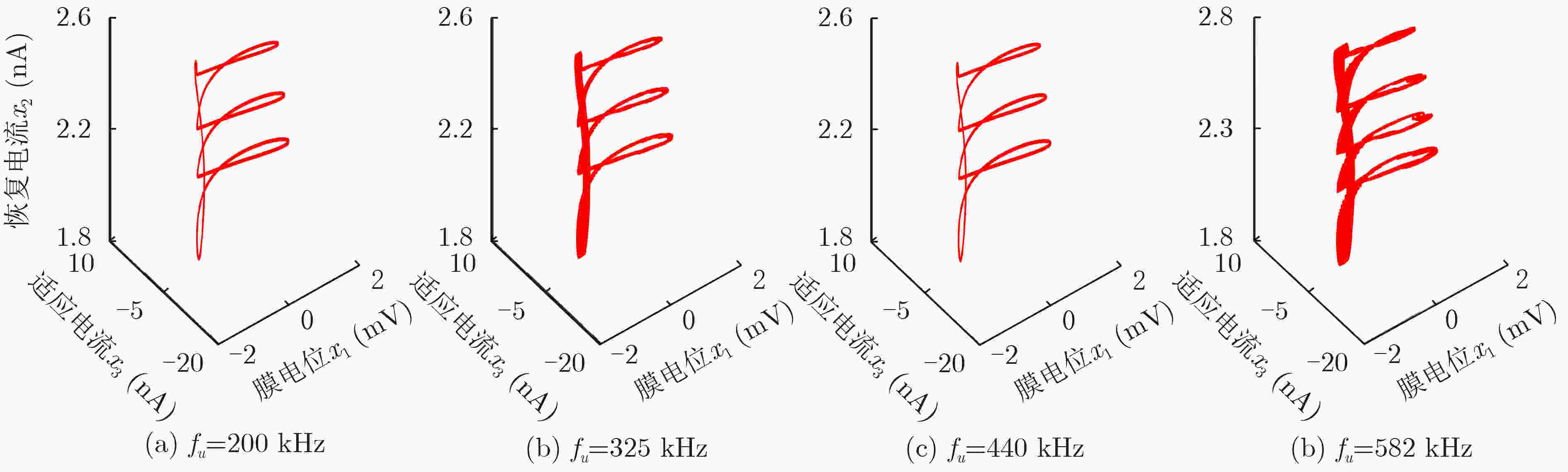
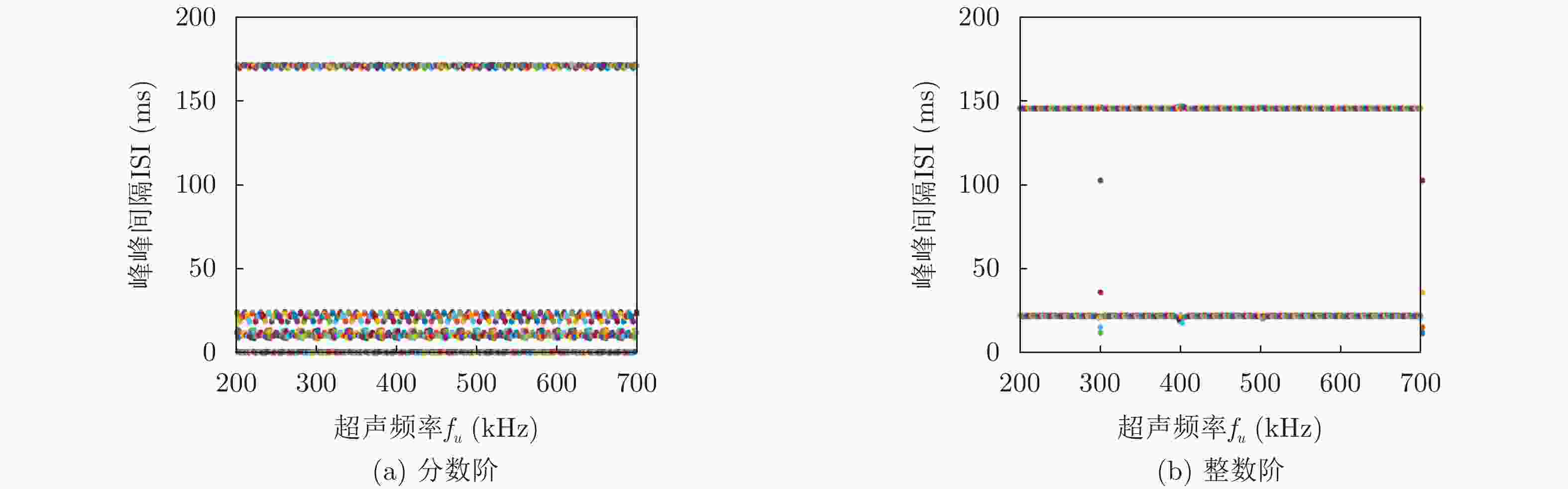
摘要: 该文基于分数阶扩展Hindmarsh-Rose(HR)神经元模型,对其在经颅磁声刺激(TMAS)影响下的放电模式和放电频率进行了分析研究。作为神经元的外部刺激输入,具有不同磁声参数的经颅磁声刺激产生的交变电流会对神经元的放电特性产生不同的影响。通过对不同磁感应强度、超声强度以及超声频率下神经元的膜电位曲线以及以磁声参数为变量的峰峰间隔分岔图进行定量分析可知,分数阶扩展HR神经元模型放电模式和放电节律的调节可通过改变经颅磁声刺激的磁感应强度和超声强度来实现。然而,超声频率的改变不会对神经元放电模式产生影响,但其取值变化会在小范围内影响神经元的放电频率。此外,通过对比分数阶与整数阶神经元在不同磁声参数交变电流刺激下的放电特性可知,分数阶扩展HR神经元模型具有更多变的放电模式和更复杂的放电节律。该文的结论有利于了解经颅磁声刺激的影响机制,进而为其实验和临床应用提供理论依据。
-
关键词:
- 经颅磁声刺激 /
- 放电特性 /
- 分数阶 /
- Hindmarsh-Rose神经元模型 /
- 混沌
Abstract: In this paper, the firing modes and spike frequencies of the fractional-order extended Hindmarsh-Rose(HR) neuronal model under Transcranial Magneto-Acoustical Stimulation (TMAS) are investigated. The TMAS with different parameters generate different alternating current and further have various effect on the firing characteristics of the neuronal model. To address the effect of TMAS on firing characteristics under different ultrasound and magnetic field parameters, the membrane potential curves and bifurcation diagrams are exhibited and analyzed. The results show that the firing mode and spike frequency are strongly dependent on the ultrasonic and magnetic field intensities. It is also found that there is no influence of the ultrasonic frequency on the firing mode, though it changes the firing frequency over a small range. Moreover, compared with the integer-order neuronal model, the fractional-order extended HR neuronal model exhibits more variable firing modes and more complex discharge rhythms. These conclusions reveal the influencing mechanism of TMAS and can be taken as theoretical basis for TMAS experimental and clinical application. -
表 1 磁声参数的可调范围
磁声参数变量 可调范围 Bx 0.5~3.0 T Γu 0.5~15 W/cm2 fu 100~600 kHz -
[1] 袁毅, 庞娜, 陈玉东, 等. 经颅磁声刺激作用下神经元放电频率适应性的研究[J]. 生物医学工程学杂志, 2017, 34(6): 934–941.YUAN Yi, PANG Na, CHEN Yudong, et al. Study of neuronal spike-frequency adaptation with transcranial magneto-acoustical stimulation[J]. Journal of Biomedical Engineering, 2017, 34(6): 934–941. [2] 李江涛, 郑敏军, 曹辉. 经颅磁刺激技术的研究进展[J]. 高电压技术, 2016, 42(4): 1168–1178.LI Jiangtao, ZHENG Minjun, and CAO Hui. Research progress in transcranial magnetic stimulation technology[J]. High Voltage Engineering, 2016, 42(4): 1168–1178. [3] 于阳, 李玥, 张广浩, 等. 适用于临床及动物试验的高频重复经颅磁刺激系统设计及其应用[J]. 高电压技术, 2013, 39(1): 181–187. doi: 10.3969/j.issn.1003-6520.2013.01.026YU Yang, LI Yue, ZHANG Guanghao, et al. Design and application of high frequency repetitive transcranial magnetic stimulation system for clinical and animal tests[J]. High Voltage Engineering, 2013, 39(1): 181–187. doi: 10.3969/j.issn.1003-6520.2013.01.026 [4] 张帅, 史勋, 尹宁, 等. 基于H-H神经元模型的经颅磁声刺激对神经元放电活动的影响[J]. 高电压技术, 2019, 45(4): 1124–1130.ZHANG Shuai, SHI Xun, YIN Ning, et al. Effects of transcranial magneto-acoustical stimulation on neuronal firing activities based on H-H neuron model[J]. High Voltage Engineering, 2019, 45(4): 1124–1130. [5] WANG Yuexiang, FENG Lina, LIU Shikun, et al. Transcranial magneto-acoustic stimulation improves neuroplasticity in hippocampus of Parkinson’s disease model mice[J]. Neurotherapeutics, 2019, 16(4): 1210–1224. doi: 10.1007/s13311-019-00732-5 [6] ZHANG Shuai, CUI Kun, ZHANG Xueying, et al. Effect of transcranial ultrasonic-magnetic stimulation on two types of neural firing behaviors in modified izhikevich model[J]. IEEE Transactions on Magnetics, 2018, 54(3): 5000204. [7] NATARAJAN A and HASLER J. Hodgkin–Huxley neuron and FPAA dynamics[J]. IEEE Transactions on Biomedical Circuits and Systems, 2018, 12(4): 918–926. doi: 10.1109/TBCAS.2018.2837055 [8] YU Hongjie and PENG Jianhua. Chaotic synchronization and control in nonlinear-coupled Hindmarsh–Rose neural systems[J]. Chaos, Solitons & Fractals, 2006, 29(2): 342–348. [9] KUMAR D, SINGH J, and BALEANU D. A new numerical algorithm for fractional Fitzhugh–Nagumo equation arising in transmission of nerve impulses[J]. Nonlinear Dynamics, 2018, 91(1): 307–317. doi: 10.1007/s11071-017-3870-x [10] ERMENTROUT B. Linearization of F-I curves by adaptation[J]. Neural Computation, 1998, 10(7): 1721–1729. doi: 10.1162/089976698300017106 [11] TSUMOTO K, KITAJIMA H, YOSHINAGA T, et al. Bifurcations in Morris–Lecar neuron model[J]. Neurocomputing, 2006, 69(4/6): 293–316. [12] STOLIAR P, TRANCHANT J, CORRAZE B, et al. A leaky-integrate-and-fire neuron analog realized with a Mott Insulator[J]. Advanced Functional Materials, 2017, 27(11): 1604740. doi: 10.1002/adfm.201604740 [13] MOUJAHID A, D’ANJOU A, TORREALDEA F J, et al. Efficient synchronization of structurally adaptive coupled Hindmarsh–Rose neurons[J]. Chaos, Solitons & Fractals, 2011, 44(11): 929–933. [14] LÜ Mi, WANG Chunni, REN Guodong, et al. Model of electrical activity in a neuron under magnetic flow effect[J]. Nonlinear Dynamics, 2016, 85(3): 1479–1490. doi: 10.1007/s11071-016-2773-6 [15] LV Mi and MA Jun. Multiple modes of electrical activities in a new neuron model under electromagnetic radiation[J]. Neurocomputing, 2016, 205: 375–381. doi: 10.1016/j.neucom.2016.05.004 [16] VEPA R. Modelling and estimation of chaotic biological neurons[J]. IFAC Proceedings Volumes, 2009, 42(7): 27–32. doi: 10.3182/20090622-3-UK-3004.00008 [17] RECH P C. Dynamics in the parameter space of a neuron model[J]. Chinese Physics Letters, 2012, 29(6): 060506. doi: 10.1088/0256-307X/29/6/060506 [18] RAJAGOPAL K, KHALAF A J M, PARASTESH F, et al. Dynamical behavior and network analysis of an extended Hindmarsh–Rose neuron model[J]. Nonlinear Dynamics, 2019, 98(1): 477–487. doi: 10.1007/s11071-019-05205-0 [19] LUNDSTROM B N, HIGGS M H, SPAIN W J, et al. Fractional differentiation by neocortical pyramidal neurons[J]. Nature Neuroscience, 2008, 11(11): 1335–1342. doi: 10.1038/nn.2212 [20] ANASTASIO T J. The fractional-order dynamics of brainstem Vestibulo-Oculomotor Neurons[J]. Biological Cybernetics, 1994, 72(1): 69–79. doi: 10.1007/BF00206239 [21] DONG Jun, ZHANG Guangjun, XIE Yong, et al. Dynamic behavior analysis of fractional-order Hindmarsh–Rose neuronal model[J]. Cognitive Neurodynamics, 2014, 8(2): 167–175. doi: 10.1007/s11571-013-9273-x [22] XIE Yong, KANG Yanmei, LIU Yong, et al. Firing properties and synchronization rate in fractional-order Hindmarsh-Rose model neurons[J]. Science China Technological Sciences, 2014, 57(5): 914–922. doi: 10.1007/s11431-014-5531-3 [23] GIRESSE T A, CREPIN K T, and MARTIN T. Generalized synchronization of the extended Hindmarsh–Rose neuronal model with fractional order derivative[J]. Chaos, Solitons & Fractals, 2019, 118: 311–319. [24] YUAN Yi, PANG Na, CHEN Yudong, et al. A phase-locking analysis of neuronal firing rhythms with transcranial magneto-acoustical stimulation based on the Hodgkin-Huxley neuron model[J]. Frontiers in Computational Neuroscience, 2017, 11: 1. [25] YUAN Yi, CHEN Yudong, and LI Xiaoli. Theoretical analysis of transcranial magneto-acoustical stimulation with Hodgkin-Huxley neuron model[J]. Frontiers in Computational Neuroscience, 2016, 10: 35. [26] LIU Dan, ZHAO Song, LUO Xiaoyuan, et al. Unidirectional synchronization of Hodgkin-Huxley neurons with prescribed performance under transcranial magneto-acoustical simulation[J]. Frontiers in Neuroscience, 2019, 13: 1061. doi: 10.3389/fnins.2019.01061 [27] LIU Dan, ZHAO Song, LUO Xiaoyuan, et al. Synchronization for fractional-order extended Hindmarsh-Rose neuronal models with magneto-acoustical stimulation input[J]. Chaos, Solitons & Fractals, 2021, 144: 110635. [28] 汪芃, 李倩昀, 唐国宁. Hindmarsh-Rose神经元阵列自发产生螺旋波的研究[J]. 物理学报, 2018, 67(3): 030502. doi: 10.7498/aps.67.20172140WANG Peng, LI Qianyun, and TANG Guoning. Spontaneous generation of spiral wave in the array of Hindmarsh-Rose neurons[J]. Acta Physica Sinica, 2018, 67(3): 030502. doi: 10.7498/aps.67.20172140 [29] MENG Fanqi, ZENG Xiaoqin, and WANG Zuolei. Dynamical behavior and synchronization in time-delay fractional-order coupled neurons under electromagnetic radiation[J]. Nonlinear Dynamics, 2019, 95(2): 1615–1625. doi: 10.1007/s11071-018-4648-5 -




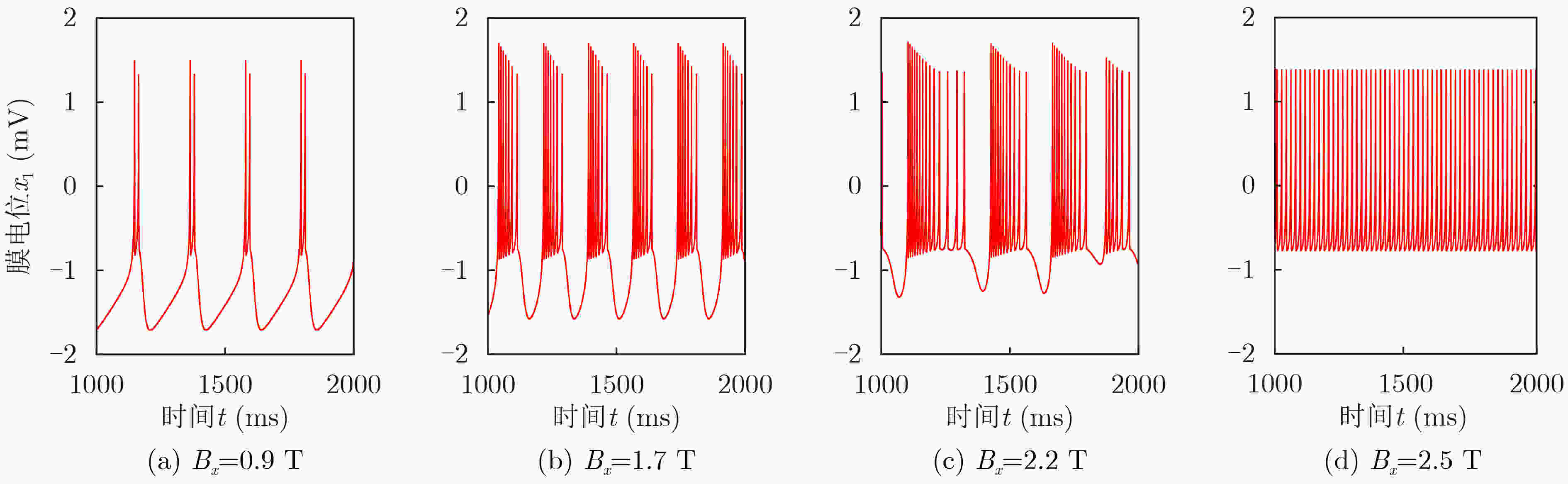

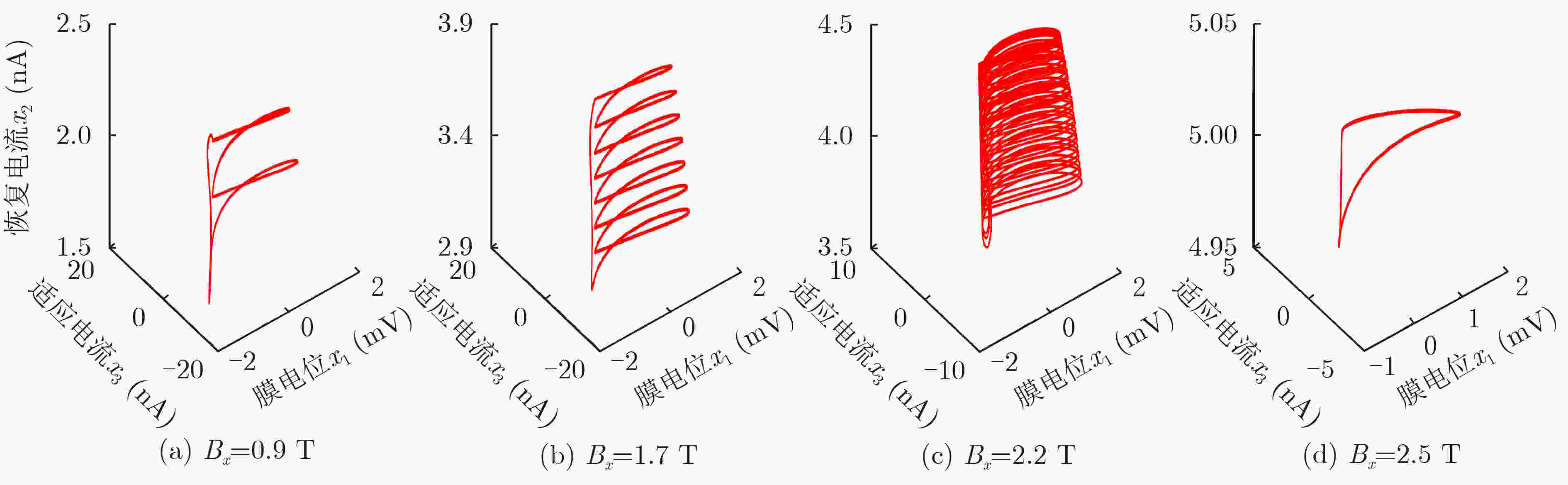
 下载:
下载:

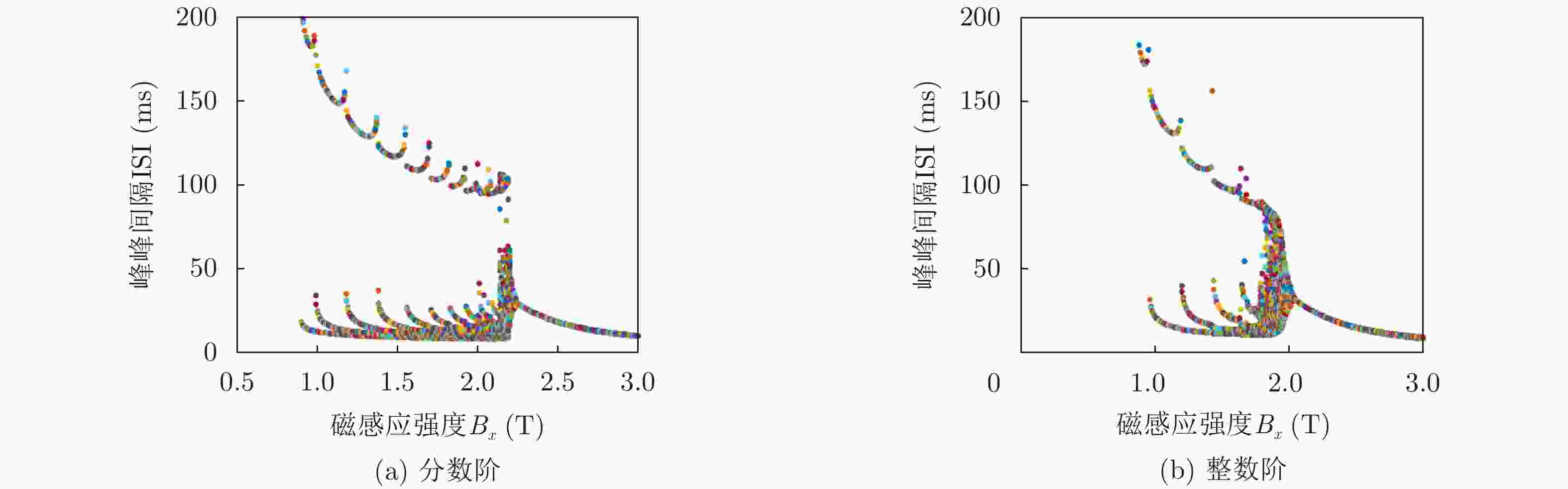
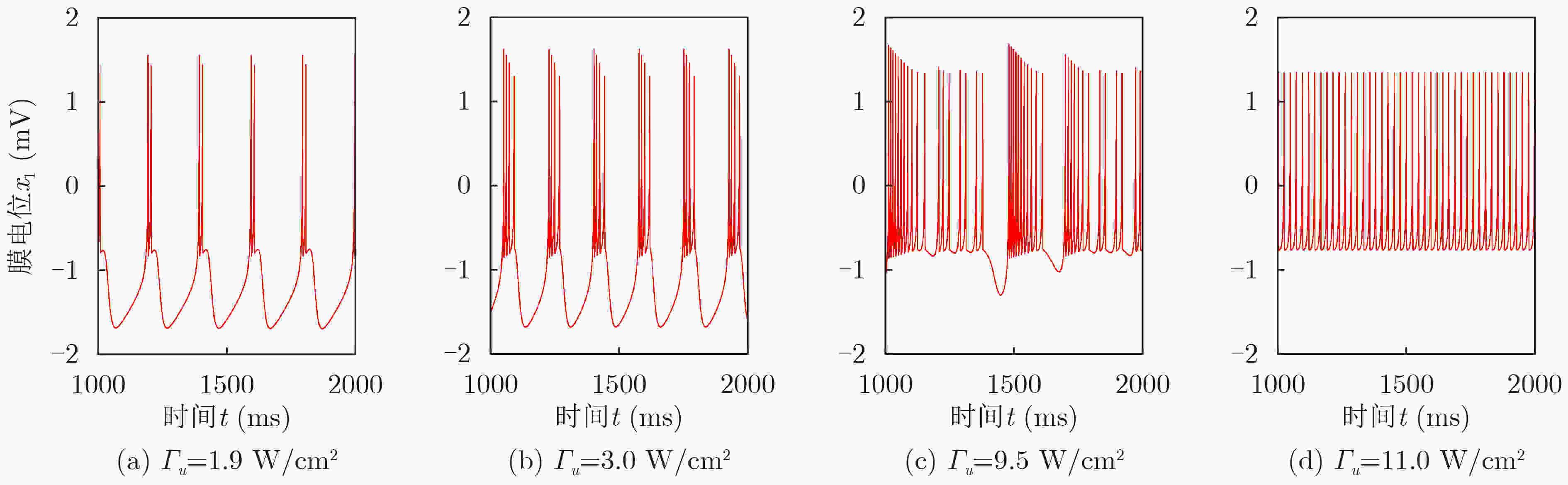





 下载:
下载:
